您現在的位置: 百濟新特藥房網首頁 >> 腫瘤科 >> 腫瘤常規用藥及解答
腫瘤骨轉移的治療
- 來源: 新特藥房藥訊 作者:百濟動態 瀏覽: 發布時間:2008/1/11 11:14:00
骨轉移的病理機制:
由于骨組織的微環境非常適合生長,因此腫瘤細胞很容易在骨骼中定殖,早在100多年以前,Stephen Paget便已描述了這一現象。如圖1.1所示,破骨細胞可以釋放多種可溶性生長因子,如白介素-6和轉化生長因子-b,這些生長因子可以刺激腫瘤細胞的生長。腫瘤細胞也能產生大量可溶性因子,如甲狀旁腺激素相關蛋白(PTHrP),從而直接或間接刺激破骨細胞降解骨質并釋放更多的生長因子。如此便形成骨質破壞的惡性循環。
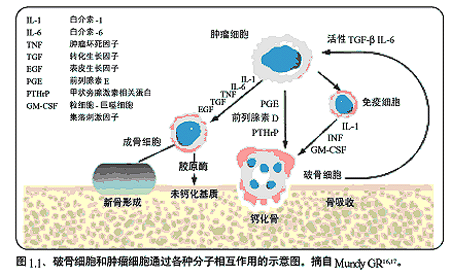
骨損害的類型:
骨損害有兩種類型,即溶骨型和成骨型。多發性骨髓瘤通常產生溶骨型損害,乳腺癌通常引起以溶骨為主的混合型骨損害,但也可產生成骨型骨損害。前列腺癌通常表現為成骨型骨損害。溶骨型骨損害以破骨細胞活性增強為特征,表現為骨質破壞或吸收的速度異常加快。在正常情況下,成骨細胞介導的骨形成的加快可以抵消破骨細胞活性增強帶來的影響。但由于一些目前還不了解的原因,成骨細胞活性受到抑制,從而引起過度骨吸收,導致骨量減少,并產生各種相關并發癥。成骨型骨損害的特點為骨轉換速度明顯加快,表現為腫瘤細胞周圍的溶骨和成骨作用均增強。形成這種硬化性(即成骨型)骨損害的確切機制尚不明確,可能是腫瘤細胞產生的骨生長因子導致骨形成增加。例如前列腺癌細胞可以產生多種生長因子,如轉化生長因子b-2,堿性纖維母細胞生長因子1和2,骨形態發生蛋白,PTHrP,前列腺特異性抗原和內皮素-1。這些生長因子可能是導致骨形成增加的介質。
骨損害的診斷:
骨痛是骨損害的常見臨床表現,也是發生骨轉移的顯著標志。典型患者產生頑固性骨痛,可呈持續性或間歇性。多發性骨髓瘤及產生成骨型損害的前列腺癌患者表現更為典型。骨損害可通過各種影像學檢查和實驗室檢查進行診斷。常用的影像學檢查方法有X光平片和锝-99m(99mTc)骨掃描。溶骨型骨損害在X光平片檢查中常表現為低密度區(圖1.2),在骨掃描中表現為放射性增強區域,但多發性骨髓瘤骨損害的99mTc骨掃描常表現正常。計算機斷層掃描、核磁共振(MRI)和氟-18正電子發射斷層(F-18-PET)掃描也對骨損害有診斷價值。
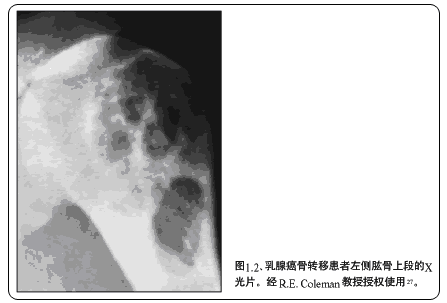
X光平片和99mTc骨掃描是檢查骨轉移的標準方法,X光平片也是評價療效和骨損害進展的標準方法。計算機斷層掃描(圖1.3)可用于證實診斷,但不如MRI或F-18-PET敏感。核磁共振的敏感性很高,能夠可靠地反映治療、疾病進展或骨折引起的骨骼變化(圖1.4),最適于檢查脊柱轉移。最近有一項分析顯示,當用于乳腺癌患者時,F-18-PET可以準確發現99mTc骨掃描無法檢出的早期微小病灶(圖1.5)。
高鈣血癥的臨床表現:
溶骨增強導致大量骨鈣釋放入血,引起多尿和胃腸道功能紊亂,伴有進行性脫水和腎小球濾過率下降。這導致鈣離子在腎臟的重吸收增加,形成高鈣血癥不斷加重的惡性循環。由于血清鈣水平不同,HCM患者的癥狀也可輕可重,但是否產生臨床癥狀和癥狀的嚴重程度似乎與血清鈣濃度并沒有嚴格的相關性。血清鈣的正常范圍(經血清白蛋白濃度校正)為2.0-2.7mmol/L(8.0-10.8 mg/dL)。
臨床癥狀:
■輕度HCM:HCM癥狀輕微,包括食欲減退、惡心、體重下降、虛弱、便秘和精神狀態改變,常在校正后血清鈣(CSC)濃度≥3mmol/L(12 mg/dL)時發生。這些癥狀很難與腫瘤引起的癥狀或抗癌治療不良反應區分。
■ 中度HCM:當CSC濃度超過3.2 mmol/L(12.8 mg/dL)時,可引起腎 功能不全和器官組織中的鈣沉積。
■ 重度HCM:CSC>3.4 mmol/L(13.5 mg/dL)時,患者會出現一些緊急 情況,需要立即給予積極的治療。這些患者會出現高鈣血癥危象相關的 極為嚴重的癥狀,如重度惡心和嘔吐、脫水、腎功能不全以及意識模糊或喪失。
■ 危及生命的HCM:CSC>3.7 mmol/L(14.8 mg/dL)時可引起昏迷和心臟驟停。
惡
惡性腫瘤骨并發癥的治療:
■ 中度HCM:當CSC濃度超過3.2 mmol/L(12.8 mg/dL)時,可引起腎 功能不全和器官組織中的鈣沉積。
■ 重度HCM:CSC>3.4 mmol/L(13.5 mg/dL)時,患者會出現一些緊急 情況,需要立即給予積極的治療。這些患者會出現高鈣血癥危象相關的 極為嚴重的癥狀,如重度惡心和嘔吐、脫水、腎功能不全以及意識模糊或喪失。
■ 危及生命的HCM:CSC>3.7 mmol/L(14.8 mg/dL)時可引起昏迷和心臟驟停。
惡
惡性腫瘤骨并發癥的治療:
目前,惡性腫瘤骨并發癥的治療方法有雙膦酸鹽、放療、手術和鎮痛藥物,這些方法主要是為了緩解癥狀。但也有一些資料顯示,雙膦酸鹽可以延長某些亞組患者的生存時間。惡性腫瘤骨并發癥的主要治療目標是最大程度緩解疼痛、減少并發癥和改善患者的活動能力與生活質量。放療可以迅速緩解60%-80%患者因腫瘤引起的疼痛。矯形手術可用于固定骨骼,從而預防骨折和緩解疼痛。另外,多數患者會接受化療或激素治療,這樣可以降低腫瘤負荷,延緩骨并發癥的發生。
HCM的治療方案包括:
1)通過有效的抗癌治療減少體液因子的產生,尤其是PTHrP,該因子可以刺激骨吸收和腎小管對鈣離子的重吸收;
2)補充足量水份,促進腎臟排泄過量鈣離子;
3)抑制骨吸收,從而去除血清鈣的主要來源。近年來,抗癌治療方法的改善降低了HCM的發生率,現在患者通常在晚期、轉移性惡性腫瘤的終末階段才產生HCM。采用雙膦酸鹽治療并補充足量水份可以使多數癌癥患者的CSC恢復正常。
雙膦酸類
靜脈輸注雙膦酸鹽是治療HCM的標準方法,并且已成為目前治療骨轉移、減少并延緩骨并發癥發生的藥物之一。雙膦酸鹽也可以減少患者對放療或手術的需求。另外,動物模型顯示,雙膦酸鹽還可以抑制骨骼微環境為腫瘤細胞生長提供的有利條件,從而減輕骨骼的腫瘤負荷。
雙膦酸鹽是人工合成的焦磷酸鹽類似物,但比焦磷酸鹽更為穩定,且不被破骨細胞產生的酶水解。通過在核心碳原子上添加不同側鏈,研究人員合成了多種臨床活性和作用強度不同的雙膦酸鹽。不含氮的雙膦酸鹽(如羥乙雙膦酸鹽、氯屈膦酸鹽和替魯膦酸鹽)在細胞內代謝,產生具有細胞毒性、不能被水解的三磷酸腺苷類似物。含氮雙膦酸鹽,如阿侖膦酸鈉、伊班膦酸鹽、帕米膦酸二鈉、利塞膦酸鹽和唑來膦酸,可以抑制蛋白質的修飾(異戊二烯化),對破骨細胞介導的骨吸收抑制作用更強。
雙膦酸鹽是人工合成的焦磷酸鹽類似物,但比焦磷酸鹽更為穩定,且不被破骨細胞產生的酶水解。通過在核心碳原子上添加不同側鏈,研究人員合成了多種臨床活性和作用強度不同的雙膦酸鹽。不含氮的雙膦酸鹽(如羥乙雙膦酸鹽、氯屈膦酸鹽和替魯膦酸鹽)在細胞內代謝,產生具有細胞毒性、不能被水解的三磷酸腺苷類似物。含氮雙膦酸鹽,如阿侖膦酸鈉、伊班膦酸鹽、帕米膦酸二鈉、利塞膦酸鹽和唑來膦酸,可以抑制蛋白質的修飾(異戊二烯化),對破骨細胞介導的骨吸收抑制作用更強。
第一代、不含氮雙膦酸鹽,如羥乙雙膦酸鹽、氯屈膦酸鹽和替魯膦酸鹽,大約在30年前被引入臨床。這些藥物具有不含氮原子的簡單側鏈。
■ 含氮雙膦酸鹽,包括帕米膦酸二鈉、阿侖膦酸鈉和伊班膦酸鹽,具有 一個含有單一氮原子的脂肪族側鏈。這些藥物抑制骨吸收的作用強于 第一代藥物。
■ 具有雜環結構的含氮雙膦酸鹽(如利塞膦酸鹽)在作用強度和療效比 方面有了進一步提高。
■ 擇泰®是一種咪唑衍生物,其環狀側鏈含有兩個氮原子,是目前作用最強的靜脈使用雙膦酸鹽
■ 含氮雙膦酸鹽,包括帕米膦酸二鈉、阿侖膦酸鈉和伊班膦酸鹽,具有 一個含有單一氮原子的脂肪族側鏈。這些藥物抑制骨吸收的作用強于 第一代藥物。
■ 具有雜環結構的含氮雙膦酸鹽(如利塞膦酸鹽)在作用強度和療效比 方面有了進一步提高。
■ 擇泰®是一種咪唑衍生物,其環狀側鏈含有兩個氮原子,是目前作用最強的靜脈使用雙膦酸鹽
雙膦酸的作用機制:
雙膦酸鹽已被證實可以有效抑制骨吸收,靜脈治療尤為有效。雙膦酸鹽可以在礦化骨基質中積聚,難以被破骨細胞溶解。起初,人們以為雙膦酸鹽對骨吸收的抑制作用主要通過這種物理化學作用增強礦化骨基質穩定性而產生,但近年來,這些藥物對破骨細胞產生的分子和細胞學影響已經逐漸被闡明。目前已經知道,雙膦酸鹽在溶骨過程中被釋放,并被破骨細胞吸收,可以抑制破骨細胞的產生及溶骨活性,縮短其存活時間,還能通過調節成骨細胞與破骨細胞之間的信號傳遞間接抑制破骨細胞活性(圖1.1)。
含氮雙膦酸鹽具有獨特的作用機制-抑制甲醛戊酸生物合成通路。第一代雙膦酸鹽在代謝后產生具有細胞毒性的三膦酸腺苷類似物,而含氮雙膦酸鹽可以抑制焦膦酸法尼酯合成酶的活性,該酶是甲醛戊酸通路中的關鍵酶。甲醛戊酸通路負責膽固醇、其他甾醇和類異戊二烯脂質的生物合成。后者為一些重要小分子酶(GTP酶)異戊二烯化的必須成分。這些酶(如Ras和Rho)是重要的細胞內信號蛋白,在異戊二烯化后被激活,可以調節破骨細胞形態發生、功能和存活所需的多種細胞內過程,如對刺激因素(如PTHrP)的反應、細胞骨架排列、細胞膜變形以及細胞凋亡。含氮雙膦酸鹽可以抑制GTP酶異戊二烯化(主要為Ras的法尼酯化),從而影響破骨細胞功能,具有細胞抑制作用,并能誘導破骨細胞凋亡。改變雙膦酸鹽含氮側鏈的結構可以影響其對破骨細胞所介導骨吸收的抑制強度。這也是第一次有證據表明,改變雙膦酸鹽結構可以產生直接生化效應,而這種作用依賴于其對蛋白質異戊二烯化的抑制能力。
含氮雙膦酸鹽具有獨特的作用機制-抑制甲醛戊酸生物合成通路。第一代雙膦酸鹽在代謝后產生具有細胞毒性的三膦酸腺苷類似物,而含氮雙膦酸鹽可以抑制焦膦酸法尼酯合成酶的活性,該酶是甲醛戊酸通路中的關鍵酶。甲醛戊酸通路負責膽固醇、其他甾醇和類異戊二烯脂質的生物合成。后者為一些重要小分子酶(GTP酶)異戊二烯化的必須成分。這些酶(如Ras和Rho)是重要的細胞內信號蛋白,在異戊二烯化后被激活,可以調節破骨細胞形態發生、功能和存活所需的多種細胞內過程,如對刺激因素(如PTHrP)的反應、細胞骨架排列、細胞膜變形以及細胞凋亡。含氮雙膦酸鹽可以抑制GTP酶異戊二烯化(主要為Ras的法尼酯化),從而影響破骨細胞功能,具有細胞抑制作用,并能誘導破骨細胞凋亡。改變雙膦酸鹽含氮側鏈的結構可以影響其對破骨細胞所介導骨吸收的抑制強度。這也是第一次有證據表明,改變雙膦酸鹽結構可以產生直接生化效應,而這種作用依賴于其對蛋白質異戊二烯化的抑制能力。
TAG:骨轉移 擇泰 雙膦酸鹽
相關藥品








