您現在的位置: 百濟新特藥房網首頁 >> 腫瘤科 >> 新藥推薦
吉粒芬-----(重組人粒細胞集落刺激因子注射液)--升白藥
- 來源: 新特藥房藥訊 作者:百濟動態 瀏覽: 發布時間:2007-8-1 14:42:00
吉粒芬(重組人粒細胞集落刺激因子注射液)——升白藥
作用于骨髓中性粒細胞系的造血干細胞,促進其增殖、分化,從而加速成熟中性粒細胞的生成,且能促進其從骨髓向外周血液釋放,并增強成熟中性粒細胞的功能。


藥物別名:重組人粒細胞集落刺激因子注射液(rhG-CSF)
藥物類別:升白藥
吉粒芬系基因重組的人粒細胞集落刺激因子(rhG-CSF)注射液,其有效成分是利用中國人G-CSF基因,由大腸桿菌表達的非糖基化蛋白質,由175個氨基酸殘基組成,具有與天然G-CSF相同的生物學特性。
藥理作用:
本品作用于骨髓中性粒細胞系的造血干細胞,促進其增殖、分化,從而加速成熟中性粒細胞的生成,且能促進其從骨髓向外周血液釋放,并增強成熟中性粒細胞的功能。
臨床前動物試驗(ICR小鼠及恒河猴)及人體臨床試驗表明本品靜脈或皮下注射,24-48小時后外周血液中性粒細胞數明顯提高,出現第一個高峰,隨后于第10-16天左右出現第二個高峰。本品對心率、血壓、心電圖、呼吸和肝腎功能均無明顯影響。
適應癥:
1. 癌癥化療等原因導致的中性粒細胞減少癥;
2. 促進骨髓移植后中性粒細胞數升高;
3. 骨髓增生異常綜合癥伴中性粒細胞減少癥;
4. 再生障礙性貧血伴發的中性粒細胞減少癥;
5. 先天性、特發性中性粒細胞減少癥;
用法與用量:
化療藥物給藥結束后21-48小時起皮下注射本品,每日一次。本品的用量和用藥時間應根據患者化療的強度和中性粒細胞下降的程度決定。對化療強度較大或粒細胞下降較明顯的患者以2.5μg/kg體重/日的劑量連續用藥7天以上較為適宜,至中性粒細胞恢復至5,000/mm3停藥;如所用化療藥物的劑量較低,估計造成的骨髓抑制不太嚴重者,可考慮使用較低劑量預防中性粒細胞減少,以1.25μg/kg體重/日的劑量用藥至中性粒細胞數穩定于安全范圍;對化療后中性粒細胞已明顯降低的患者(中性粒細胞<1,000mm3),以5μg/kg體重/日的劑量用藥至中性粒細胞數恢復至5,000/mm3以上,穩定后終止本品治療并監視病情。
禁忌癥:
對本品或同類制劑以及對大腸桿菌表達的其他制劑有過敏史者禁用。
不良反應:
患者使用本品后主要的不良反應為骨和(或)肌肉酸痛及乏力,個別病人可見皮疹、發熱、流涕或寒戰等類感冒癥狀,上述不良反應均較輕微,易于耐受,一般不需特殊處理,停藥后癥狀即可消失。
注意事項:
•本品應在化療結束后24-48小時開始使用,不宜在化療前或化療療程中使用。
•使用本品過程中應定期每周監測血象二次,特別是中性粒細胞數變化情況。
•對髓性細胞系統的惡性增殖(急性粒細胞性白血病等)本品應慎重使用。
•長期使用本品的安全有效性尚未建立,曾有報導可見脾臟腫大。
•該藥僅供在醫生指導下使用。
規格:
50μg/支
75μg/支
100μg/支
150μg/支
300μg/支
貯藏:吉粒芬針劑應貯藏在2-10°C,并防止凍結。
有效期:二年
生產單位:杭州九源基因工程有限公司
相關文章
吉粒芬的【臨床研究】
吉粒芬在中山醫科大學附屬腫瘤醫院等五十多家醫院進行了I、II、III期共600多例臨床研究,和 20,000人次臨床使用,證明它在癌癥治療后應用,具有顯著升白細胞的療效和安全性,與國外同類產品完全一致。
吉粒芬已在以下疾病治療中用于預防和治療白細胞減少癥:肺癌、非何杰金氏淋巴瘤、乳腺癌、卵巢癌、胃癌、子宮癌、宮頸癌、睪丸癌、惡性淋巴瘤、鼻咽癌、骨癌、直腸癌、肝癌、軟骨肉瘤、胰腺癌、尤文氏瘤轉移胸膜癌、食道癌、結腸癌、口腔癌、惡性黑色素瘤、膽管癌、扁桃體癌、腎癌、惡性纖維組織細胞瘤和白血病。
吉粒芬給藥后24小時,因其促進骨髓中性粒細胞釋放作用,而使外周中性粒細胞絕對數量(ANC)迅速升高,于第2-6天出現第一個ANC升高峰;隨后如果連續給藥,藥物將刺激骨髓中性粒細胞前體細胞增殖、分化和釋放,于第 10-16天出現第二個升高峰,呈現典型的雙峰曲線(見下圖)。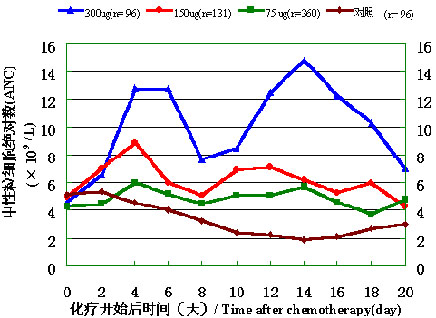

不同劑量下吉粒芬升中性粒細胞作用
吉粒芬的藥物代謝動力學
急性毒性:小鼠尾靜脈一次注射5040μg/kg本品,相當于一般臨床注射用劑量的1000倍。連續觀察10天,未觀察到中毒反應。
亞急性毒性:對小鼠給藥4周(靜脈、皮下注射注射),13周(靜脈注射)的無作用劑量為1μg/kg/日。給予10μg/kg/日以上時,可見鼠后肢股骨內膜的骨吸收與骨形成、ALP上升、脾臟重量增加等現象。在4周、13周給藥(靜脈注射)試驗中,這些現象在停藥后消失。對猴給藥4周、13周(靜脈注射)的無作用劑量分別為10μg/kg/日、1μg/kg/日以上,用1000μg/kg/日的劑量給藥4周后發生急劇的白細胞數增加(為給藥前的15~28倍),被認為是發生腦出血死亡的原因,而用100μg/kg/日的劑量給藥13周未出現死亡。另外,在各個有效劑量內可見骨髓中的原紅細胞減少、脾臟腫大等現象。13周給藥試驗在停藥以后,上述現象恢復正常。幼鼠的試驗結果與成年鼠的結果一樣,藥理作用及毒性均未見差異。
慢性毒性:180μg/kg給Beagle狗連續皮下注射rhG-CSF29天可產生較明顯的毒副反應,主要表現為間歇性體溫升高,食欲減退,部分動物心電圖Ⅱ導T波倒置加深,注射部位皮膚增厚或出現紅斑,皮下組織高度水腫,炎性細胞大片浸潤,局灶性片狀壞死,部分動物骨髓原始細胞增生,脾臟增大,脾細胞增長活躍,AST和T-Bil一過性增高,個別動物肝細胞有病理改變。但上述變化在停藥30天可恢復正常。60μg/kg劑量長期給藥可產生輕度的毒性反應,主要表現為部分動物發熱,食欲減退,對注射局部皮膚組織的刺激性損傷,對骨髓和脾臟產生比180μg/kg劑量較輕的可逆性病理變化。20μg/kg劑量長期給藥未見對Beagle狗產生明顯的毒性反應。rhG-CSF20μg/kg長期皮下注射對Beagle狗是安全劑量,該劑量為本品臨床常用劑量5μg/kg的4倍。rhG-CSF連續皮下注射90天對大鼠的毒性隨劑量的增加有明顯的毒效關系。500μg/kg是有明顯毒性的劑量,在此劑量下,動物體重1周后增長速度低于對照組,雄性動物直到試驗結束仍未恢復到正常水平,且差異顯著。AST于30天時一過性增高,超出正常范圍。與造血有關的指標中,骨髓象30天的粒系比例較對照組升高,紅系相對降低,粒紅比差異顯著。脾的臟器系數在30、60天時明顯高于對照組和其他各組。網織紅細胞也高于對照組。其他指標未見明顯異常。100μg/kg可認為是基本無毒性反應的劑量,為臨床常用劑量的20倍。該組動物給藥3周、4周時,動物有短時的體重降低,30天時網織紅細胞一過性較對照組升高,骨髓象中粒紅比明顯高于對照組,可能是該藥對粒系的藥效反應。20μg/kg為安全劑量,是臨床常用劑量的4倍。在90天連續給藥過程中均未見本品對動物有明顯的毒性影響,僅骨髓象中粒紅比例較對照組高,考慮為制品本身的藥效作用。
生殖毒性:分別在鼠妊娠前、妊娠初期和器官形成期給藥(靜脈注射),對親代動物的生殖能力、胎兒、新生鼠的無作用劑量均為500μg/kg/日以上。在圍產期、哺乳期給藥,對親代動物的生殖能力、新生鼠的無作用劑量分別為100μg/kg/日以上、4μg/kg/日,在20μg/kg/日以上時可見新生鼠的發育抑制。另外,在兔器官形成期給藥(靜脈注射),對親代動物的生殖能力、胎兒的無作用劑量分別為20μg/kg/日、5μg/kg/日,在80μg/kg/日時出現母體動物的泌尿生殖器出血伴流產,在20μg/kg/日以上時存活的胎兒數減少。所有的試驗中均未見致畸作用。
抗原性:給豚鼠、兔及鼠同時用免疫增強劑(FCA或氫氧化鋁凝膠)時出現抗原性,而在單獨給藥時未見抗原性。用兔做大腸桿菌異種蛋白抗原性試驗,并用FCA時可見抗體效價升高,而單獨用本藥時未見抗體效價的升高。另外,在臨床試驗中,未發現針對本藥的抗體產生及來源于大腸桿菌的異種蛋白的抗體效價的升高。
其他:全身過敏反應試驗、致突變試驗、局部刺激性試驗及致熱試驗均未見異常。
【藥代動力學】
本品經靜脈或皮下注射后主要分布在腎臟、骨髓和血漿中,以氨基酸代謝途徑被降解,并主要由尿排泄。經皮下注射時,半衰期為3.5小時,清除率為0.5~0.7ml/min/kg。
【用法用量】
化療藥物給藥結束后24~48小時起皮下或靜脈注射本品,每日1次。本品的用量和用藥時間應根據患者化療的強度和中性粒細胞下降程度決定。對化療強度較大或粒細胞下降較明顯的患者以2.5μg/kg體重/日的劑量連續用藥7天以上較為適宜,至中性粒細胞恢復至5000/mm3停藥;如所用化療藥物的劑量較低,估計所造成的骨髓抑制不太嚴重者,可考慮使用較低劑量預防中性粒細胞減少,以1.25μg/kg體重/日的劑量用藥至中性粒細胞數穩定于安全范圍,對化療后中性粒細胞已明顯降低的患者(中性粒細<1000/mm3=,以5μg/kg體重/日的劑量用藥至中性粒細胞數恢復至5000/mm3以上,穩定后終止本品治療并監視病情。
1.用于化療所致的中性粒細胞減少癥等
成年患者化療后,中性粒細胞數降至1000/mm3(白細胞計數2000/mm3)以下者,在開始化療后2~5μg/kg,每日1次皮下或靜脈注射給藥。兒童患者化療后中性粒細胞數降至500/ mm3(白細胞計數1000/mm3)以下者,在開始化療后2~5μg/kg,每日1次皮下或靜脈注射給藥。當中性粒細胞數回升至5000/mm3(白細胞計數10000/mm3)以上時,停止給藥。
2.急性白血病化療所致的中性粒細胞減少癥
白血病患者化療后白細胞計數不足1000/mm3,骨髓中的原粒細胞明顯減少,外周血液中未見原粒細胞的情況下,成年患者2~5μg/kg每日1次皮下或靜脈注射給藥;兒童患者2μg/kg每日1次皮下或靜脈注射給藥。當中性粒細胞數回升至5000/ mm3(白細胞計數10000/mm3)以上時,停止給藥。
3.骨髓增生異常綜合征伴中性粒細胞減少癥
成年患者在其中性粒細胞不足1000/mm3時,2~5μg/kg每日1次皮下或靜脈注射給藥。中性粒細胞數回升至5000/ mm3以上時,停止給藥。
4.再生障礙性貧血所致中性粒細胞減少
成年患者在其中性粒細胞低于1000/mm3時,2~5μg/kg每日1次皮下或靜脈注射給藥。中性粒細胞數回升至5000/ mm3以上時,酌情減量或停止給藥。
5.周期性中性粒細胞減少癥、自身免疫性中性粒細胞減少癥和慢性中性粒細胞減少癥
成年患者中性粒細胞低于1000/mm3時,1μg/kg每日1次皮下或靜脈注射給藥。兒童患者中性粒細胞低于1000/mm3時,1μg/kg每日1次皮下或靜脈注射給藥。中性粒細胞數回升至5000/ mm3以上時,酌情減量或停止給藥。
6.用于促進骨髓移植患者中性粒細胞增加
成人在骨髓移植的第2日至第5日開始用藥,2~5μg/kg每日1次皮下或靜脈注射給藥。兒童在骨髓移植的第2日至第5日開始用藥,2μg/kg每日1次皮下或靜脈注射給藥。中性粒細胞回升至5000/ mm3(白細胞計數10000/mm3)以上時,停止給藥。
- 沒有相關記錄
TAG:重組人粒細胞集落刺激因子 吉粒芬 Recombinant Human Granulocyte Colony-stimulating Factor Injection
相關藥品

十年全國連鎖專科藥房,藥監局認證網上藥店,分店覆蓋全國各大城市,數十位執業藥師免費用藥指導,網上買藥首選!
網站資訊- 藥房介紹 |
連鎖門店分布 | 人才招聘 |
聯系我們 | 網站地圖
便民幫助- 常見問題 | 服務指南 | 藥學服務 | 顧客意見 | 顧客投訴 | 專科服務 | 尋醫問藥 | 藥師窗口
專科分類服務- 腫瘤科 | 肝病科 | 神經科 | 精神科 | 皮膚性病科 | 眼 科 | 風濕免疫科 | 心血管科 | 糖尿病科 | 其他科用藥
藥品導購服務- 腫瘤科藥品 | 精神科藥品 | 肝病科藥品 | 眼科藥品 |皮膚性病科藥品 | 神經科藥品 | 風濕免疫科藥品
藥房資質- 企業法人營業執照 | 藥品經營許可證 | 藥品經營質量管理規范認證 | 食品衛生許可證 | 互聯網藥品信息服務資格證
便民幫助- 常見問題 | 服務指南 | 藥學服務 | 顧客意見 | 顧客投訴 | 專科服務 | 尋醫問藥 | 藥師窗口
專科分類服務- 腫瘤科 | 肝病科 | 神經科 | 精神科 | 皮膚性病科 | 眼 科 | 風濕免疫科 | 心血管科 | 糖尿病科 | 其他科用藥
藥品導購服務- 腫瘤科藥品 | 精神科藥品 | 肝病科藥品 | 眼科藥品 |皮膚性病科藥品 | 神經科藥品 | 風濕免疫科藥品
藥房資質- 企業法人營業執照 | 藥品經營許可證 | 藥品經營質量管理規范認證 | 食品衛生許可證 | 互聯網藥品信息服務資格證